發布時間:2022-09-20 瀏覽量:0

外泌體研究自過去二十年以來一直是焦點領域。人體內多種細胞在正常以及病理狀態下均可分泌外泌體,如間充質干細胞、內皮細胞、腫瘤細胞、骨髓細胞、免疫細胞等。外泌體與干細胞有著類似的功能,在組織工程與再生醫學方面的臨床前期研究,尤其是干細胞外泌體。
外泌體的分離和純化是外泌體相關基礎研究和臨床應用的瓶頸問題之一。各種研究表明,外泌體的臨床應用存在一些挑戰,因為在各種純化過程中,沒有將外泌體與其他微粒分離以及分離各種外泌體亞群的標準方法。下面將簡單介紹下外泌體的不同分離純化方法。

目前外泌體分離的最傳統和最廣泛使用的技術之一是差速離心,它根據密度和大小純化外泌體。該方法最常見的操作是先低速去除細胞及碎片,再通過超速離心形成外泌體沉淀,進而實現外泌體的富集。該方法簡單、有效且經濟,但該過程的產量和特異性較低,還可能被其他類似大小的微粒污染。此過程中的高速離心可能會損壞外泌體。目前,差速離心已與蔗糖密度梯度或蔗糖墊相結合,以提高分離外泌體的產量和純度。

圖1:差速離心提取外泌體
切向流超濾是一種基于過濾器孔徑分離外泌體的選擇。首先用孔徑大于外泌體粒徑的濾膜或者離心法去除大顆粒,然后再用孔徑較小的超濾膜截留外泌體,從而實現外泌體的富集。過濾方法比差速超速離心省時省力,分離速度快,操作簡單。然而,由于這種方法是基于大小的,因此很難將外泌體與其他大小相同的顆粒(如凋亡小體或微泡)分離。

圖2 左:常規過濾 右:切向流過濾
尺寸排阻色譜法,類似于過濾,利用排阻層析柱里的多孔固定相,使較小的顆粒在柱子里的保留時間更長,從而實現按照粒徑大小對樣品進行分離。這種方法能夠獲得高純度的外泌體,保證外泌體的完整性和生物活性。盡管外泌體純化的產量很高,但該技術耗時,且需要專門的裝置和填料,不便于從大樣本量中獲得外泌體。
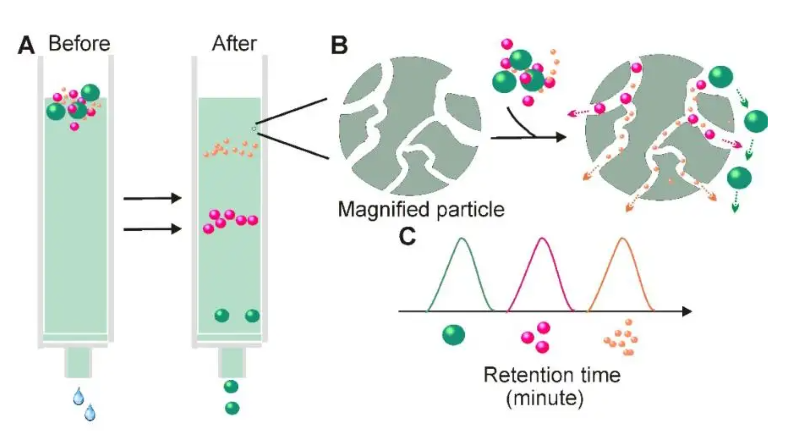
圖3:尺寸排阻色譜法提取外泌體
免疫親和捕獲法通過在層析柱、磁珠和微流控系統中將外泌體相關抗原與抗體結合,能夠獲得高純度的外泌體。這種方法能夠捕獲膜表面特定蛋白質的外泌體,可富集特定的一類外泌體,可用于分離外泌體的不同亞型。但是這種方法的成本高,產率低。
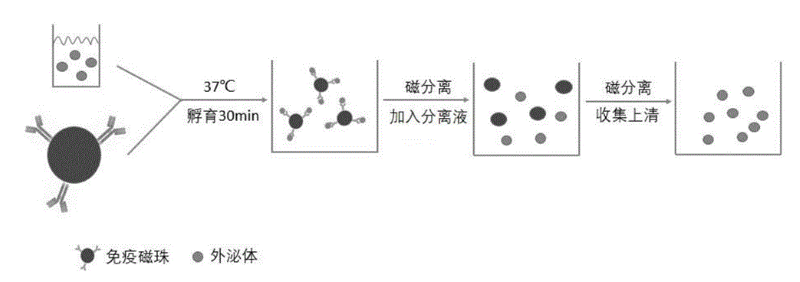
圖4:免疫磁珠分離外泌體
聚合沉淀法也可用于外泌體的純化,主要是利用聚乙二醇等聚合物,將外泌體沉淀,操作非常簡便。但是這種方法不是特異性的,可能會共沉淀其他顆粒,化學處理也可能通過該過程破壞外泌體。此外,顆粒的再懸浮很復雜,不適合功能性使用。

圖5:PEG沉降制備外泌體
總體而言,每種純化方法都有其優點和缺點,外泌體分離純化方案應該是根據樣本形式(樣本來源、樣本體積、潛在的雜質類型)和下游的應用,并且綜合考慮得率、純度、成本和時間,靈活選擇一種或多種方法提高純度和數量。
齊魯細胞基于標準化細胞培養條件,建立了完善的外泌體分離純化及檢測鑒定平臺,處理通量高、分離時間短、雜質去除率高。透射電子顯微鏡、蛋白標志物檢測以及納米流式檢測結果顯示,外泌體產品產量和純度均處于國際領先水平。


圖6.:先進的外泌體制備與檢測鑒定平臺

圖7:MSC-Exo的檢測鑒定結果
參考文獻:
[1] Hassanzadeh A, Rahman HS, Markov A, Endjun JJ, Zekiy AO, Chartrand MS, Beheshtkhoo N, Kouhbanani MAJ, Marofi F, Nikoo M, Jarahian M. Mesenchymal stem/stromal cell-derived exosomes in regenerative medicine and cancer; overview of development, challenges, and opportunities. Stem Cell Res Ther. 2021 May 21;12(1):297.