發布時間:2023-08-14 瀏覽量:0
間充質干細胞(MSCs)由于具有自我再生、分化和免疫調節的能力,已被證明是有前途的組織再生和功能修復的細胞來源。除此之外,MSCs還可以通過釋放營養因子和細胞外囊泡發揮旁分泌的作用。為滿足臨床應用的需求,通常需要在體外大規模生產MSCs。然而,MSCs的體外擴增通常受到限制,如細胞凋亡、衰老和多能性喪失等。

MSC的增殖、分化、遷移等生物學特性均是在體內一系列環境因素作用下完成的,影響MSC增殖、分化、凋亡的因素很多,主要有氧氣體積分數、溫度、生長因子、pH值等。其中氧氣體積分數為非常關鍵的作用因素,常規細胞體外培養的氧氣體積分數約為21%,CO2體積分數約為5%,而人體正常組織和組織間隙中的氧氣體積分數為3%-9%。現有研究也表明,低氧對MSC的增殖、遷移、分化以及旁分泌的功能性應用均具有一定的影響。
低氧培養條件對MSC增殖的影響
Shun-Pei Hung等人為了探究低氧對骨髓間充質干細胞的作用,將細胞在常氧(21% O2)和低氧(1% O2)狀態下培養不同時間(1、3、5、7天)。研究結果表明,與常氧組相比,在低氧狀態下培養的細胞,細胞增殖能力顯著提高。

Figure1. 常氧和低氧培養條件下MSC增殖情況對比[1]
同樣,唐建宏等也探究了不同體積分數氧氣預處理人羊膜間充質干細胞后對其生物學特性影響。將第3代人羊膜間充質干細胞通過不同體積分數氧氣進行預處理48 h,隨機分為1%,3%,5%,10% 低氧預處理組和常氧對照組(體積分數21%氧氣),并檢測細胞增殖能力。發現,低氧預處理能提高人羊膜間充質干細胞的增殖能力,且體積分數1%氧氣預處理效果優于體積分數3%,5%,10%,21%氧氣預處理。
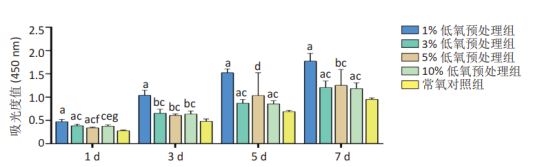
Figure2. 不同體積分數氧氣預處理
人羊膜間充質干細胞的增殖情況[2]
說明,低氧環境下更有利于MSCs在體外的增殖。
低氧培養條件對MSC分化的影響
Markus W等用2%氧氣體積分數低氧培養骨髓間充質干細胞 2 周后對細胞進行誘導分化,發現低氧條件下細胞表達成骨分化關鍵基因 RUNX2 顯著高于常氧組,但是表達的成脂分化關鍵基因 PPARg 則顯著低于常氧組,認為低氧促進間充質干細胞成骨分化而抑制成脂分化[3]。

△Figure3. 常氧組和低氧組成脂分化和
成骨分化后油紅和von-Kossa染色[3]
然而,Hye J K等在研究低氧對脂肪間充質干細胞成脂分化的影響中發現,當氧體積分數為 2% 時可以促進細胞成脂分化,但是當氧體積分數調整至 5% 時,對脂肪間充質干細胞成脂分化能力無顯著性影響[4]。
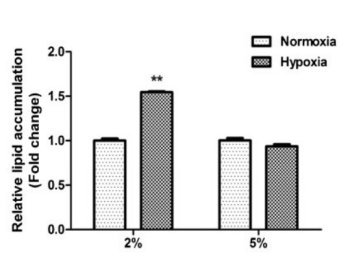
Figure4. 氧體積分數2%和5%條件下脂肪形成的測定[4]
因此,可以說明不同氧體積分數對不同來源間充質干細胞生物學特性的影響可能是不同的。
低氧培養條件對MSC外泌體的影響
低氧培養條件下可增強MSC營養因子的表達和分泌,包括生長因子,如血管內皮生長因子(VEGF)、堿性成纖維細胞生長因子(bFGF)、肝細胞生長因子(HGF)、轉化生長因子β1(TGF-β1))、胰島素樣生長因子1(IGF-1)、成纖維細胞生長因子10(FGF10) 和表皮生長因子(EGF);細胞因子,如IL-6、IL-8、趨化因子配體20(CCL-20)和單核細胞趨化蛋白-1(MCP-1);以及基質調節劑如血管生成素、金屬蛋白酶-1(TIMP-1))和金屬蛋白酶(MMP)的組織抑制劑。

Figure5. 常氧和低氧培養條件下
MSCs外泌體成分差異對比[5]
因此可以通過低氧處理MSCs來影響其外泌體中生長因子和細胞因子的含量,進而治療相關疾病。例如,低氧處理的人脂肪MSCs分泌的外泌體可以通過VEGF/VEGF-R促進血管生成[5];低氧處理的骨髓MSCs的外泌體可以通過miR-210減輕心臟梗塞[6]等。
綜上所述,低氧可以為MSCs提供一個有利的培養條件,通過不同生長因子的產生和相關基因的表達來促進MSCs的增殖、調控MSCs的分化以及影響其外分泌的功能性應用。
【參考文獻】
[1]Shun-Pei H,H J H,V Y S, et al. Hypoxia promotes proliferation and osteogenic differentiation potentials of human mesenchymal stem cells.[J]. Journal of orthopaedic research : official publication of the Orthopaedic Research Society,2012,30(2).
[2] 唐建宏,張霓霓,黃桂林等.不同體積分數氧氣預處理人羊膜間充質干細胞的生物學特性[J].中國組織工程研究,2023,27(15):2318-2324.
[3] Markus W,Timo G,L F L, et al. Hypoxia promotes osteogenesis but suppresses adipogenesis of human mesenchymal stromal cells in a hypoxia-inducible factor-1 dependent manner.[J]. PloS one,2012,7(9).
[4] Hye J K,Seok-Ho K,Yong S S, et al. Hypoxia induces adipocyte differentiation of adipose-derived stem cells by triggering reactive oxygen species generation.[J]. Cell biology international,2014,38(1).
[5] Han Y,Ren J,Bai Y, et al. Exosomes from hypoxia-treated human adipose-derived mesenchymal stem cells enhance angiogenesis through VEGF/VEGF-R[J]. International Journal of Biochemistry and Cell Biology,2019,109.
[6] Hao C,Shufu C,Rende X, et al. Hypoxia-challenged MSC-derived exosomes deliver miR-210 to attenuate post-infarction cardiac apoptosis.[J]. Stem cell research & therapy,2020,11(1).



