發布時間:2023-02-10 瀏覽量:0


心腦血管疾病是心臟血管和腦血管疾病的統稱,泛指由于高脂血癥、血液黏稠、動脈粥樣硬化、高血壓等所導致的心臟、大腦及全身組織發生的缺血性或出血性疾病。心腦血管疾病是一種嚴重威脅人類,特別是50歲以上中老年人健康的常見病,具有高患病率、高致殘率和高死亡率的特點,即使應用最先進、完善的治療手段,仍可有50%以上的腦血管意外幸存者生活不能完全自理,全世界每年死于心腦血管疾病的人數高達1500萬人,居各種死因首位[1]。

圖1:心臟示意圖
干細胞移植治療是一種新的治療方法,間充質干細胞(mesenchymal stem cells,MSCs)具有來源廣泛、取材方便、在體外容易擴增、較強的自我復制和多向分化能力、免疫原性弱、不存在倫理方面的問題、可以進行基因修飾、能分化為心肌細胞和內皮細胞等優勢,已經成為心血管疾病細胞移植治療的理想種子細胞。在過去的十年中,MSCs因促血管生成和抗炎特性被用于心血管疾病的治療,并顯示出良好的臨床效果,為心血管疾病治療帶來了新的曙光。

高血壓易導致動脈粥樣硬化( atherosclerosis,AS),AS 可導致冠心病、腦梗塞和動脈閉塞等心血管疾病。
中國人民解放軍醫院的一項研究證明了MSCs在改善高血壓中的療效。該研究采用單純收縮期高血壓大鼠(ISH)及自發性高血壓大鼠(SHR)作為研究對象,采用左心室直接注射MSCs的方法進行干預移植,4周后檢測實驗動物有創血壓、脈博傳導速度、心臟壓力-容積變化,評價動脈順應性及心功能狀態,摘取主動脈、心臟及腎臟組織分別進行病理學檢查。結果發現,ISH大鼠接受MSCs干預后,兩組間動脈壁彈力/膠原纖維比值差異顯著,MSCs干預組高于對照組;細胞外基質成分比例發生變化的同時還伴有基質形態及排列的變化;MSCs干預組彈力纖維保持固有形狀,與膠原纖維結合緊密;MSCs植入促進局部動脈組織中血紅素加氧酶及纖維粘連蛋白的表達;MSCs通過影響動脈壁中骨橋蛋白表達水平來拮抗主動脈鈣化的發生,降低組織局部鈣含量,動脈結構的改變伴有動脈順應性的改變;MSCs干預組動物脈搏波傳導速度明顯低于對照組。這都預示著MSCs對高血壓具有明顯的改善效果。
有研究報道,對15例高血壓伴糖尿病、腎病受試者在常規治療的基礎上進行MSCs移植,另外15例口服纈沙坦作為對照組,兩組患者均持續治療1個月。治療前后3個月監測患者收縮壓、舒張壓。結果顯示,MSCs組患者的舒張壓指標下降程度較對照組明顯,MSCs在改善舒張壓方面的臨床療效優于單純控制血壓等常規方法治療,糖尿病腎病等并發癥狀均得到改善[2]。

圖2:血壓檢測示意圖

MSCs被證明能夠在體外可以分化成神經譜系細胞,并且可以在動物模型的缺血性腦組織中表達神經元或神經膠質細胞。在MSCs移植后的缺血性腦卒中動物腦中,神經生長因子(NGF)增加,MSCs對缺血性腦卒中的神經保護作用可能是由這些NGF來介導的,包括抗凋亡、抗氧化、抗谷氨酸興奮毒性、抗炎活性及提高神經元存活率等[3]。最近很多研究證實,MSCs不僅可以促進組織型纖溶酶原激活劑的激活,而且能夠下調腦缺血邊界區的纖溶酶原激活物抑制劑的水平,促進神經軸突和突觸泡蛋白的產生,最終促進大鼠腦卒中模型缺損神經功能的恢復和改善。
一項MSCs移植治療腦卒中后遺癥50例臨床效果分析的研究中,研究人員對腦卒中患者50例進行MSCs移植,所有患者腰椎穿刺蛛網膜下腔植入MSCs,1次/周,共計3次。結果發現,腦卒中患者MSCs移植后6個月功能獨立性評分顯著高于移植前。預示著MSCs移植可以一定程度地改善腦卒中患者的后遺癥,提高患者生活質量[4]。

圖3:MSCs治療缺血性腦中風示意圖

在一項MSCs移植對大鼠快速右心室起搏的心力衰竭治療實驗中,MSCs移植3周后,治療組的心功能都較移植前有明顯改善,室壁厚度增加、心室腔減小、搏動增強;而對照組的心功能、室壁厚度、心室腔無明顯變化。由此看出,MSCs可以改善心肌組織的供血和促進心肌細胞再生,對心力衰竭的改善效果明顯。
在評估MSCs治療慢性收縮性心力衰竭的有效性研究中,將59例心力衰竭患者隨機分為治療組(n=30)和對照組(n=29)。治療組接受藥物治療以及臍帶間充質干細胞的冠狀動脈內移植,對照組僅接受藥物治療。1個月后,治療組的NT-proBNP和LVEF水平以及死亡率均低于對照組,說明使用MSCs治療充血性心力衰竭有助于改善心臟重塑功能,降低死亡率,證實了MSCs治療心力衰竭的有效性[5]。
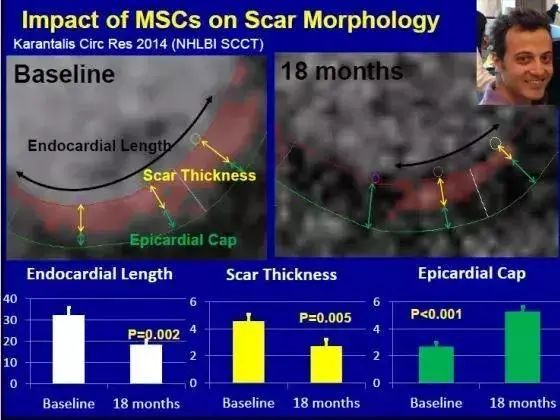
圖4:MSCs減少心臟疤痕組織與促進心肌組織再生

對MSCs的實驗及臨床應用的研究雖已取得了很大的進展,但該領域的研究尚處于探索階段,以下問題有待解決:(1)MSCs的分離、純化,實驗證明體外的MSCs均為多種細胞的混雜,如何才能有效地獲得純MSCs有待對MSCs的細胞學特點和分化各階段細胞標志物進一步研究。(2)MSCs增殖和分化的控制需要合適的條件,如何既能控制增殖避免形成腫瘤,又能在適當的時候啟動所需的分化路徑有待進一步研究。(3)如何提高所需要細胞的轉化率。
總之,隨著對MSCs研究的不斷深入及其應用于心血管疾病后令人欣喜的結果,都預示著MSCs前景十分廣闊,但同時還面臨著許多問題需要解決。相信在不久的將來,隨著人們對MSCs研究的進一步深入,MSCs在心血管疾病中的應用必將擁有更好的未來。
參考文獻
[1] T. Katsuda, R. Tsuchiya, N. Kosaka, Y. Yoshioka, K. Takagaki, K. Oki, F. Takeshita,Y. Sakai, M. Kuroda, T. Ochiya, Human adipose tissue-derived mesenchymal stem cells secrete functional neprilysin-bound exosomes, Sci. Rep. 3 (2013) 1197.
[2] M. Kim, H.W. Yun, D.Y. Park, B.H. Choi, B.H. Min, Three-dimensional spheroid culture increases exosome secretion from mesenchymal stem cells, Tissue Eng Regen Med 15 (4) (2018) 427–436.
[3] C. Salomon, J. Ryan, L. Sobrevia, M. Kobayashi, K. Ashman, M. Mitchell, G.E. Rice, Exosomal signaling during hypoxia mediates microvascular endothelial cell migration and vasculogenesis, PloS One 8 (7) (2013) e68451.
[4] S.C. Jang, O.Y. Kim, C.M. Yoon, D.S. Choi, T.Y. Roh, J. Park, J. Nilsson, J. Lotvall, Y.K. Kim, Y.S. Gho, Bioinspired exosome-mimetic nanovesicles for targeted delivery of chemotherapeutics to malignant tumors, ACS Nano 7 (9) (2013) 7698–7710.
[5] W. Jo, J. Kim, J. Yoon, D. Jeong, S. Cho, H. Jeong, Y.J. Yoon, S.C. Kim, Y.S. Gho, J. Park, Large-scale generation of cell-derived nanovesicles, Nanoscale 6 (20) (2014) 12056–12064.

