發布時間:2022-03-16 瀏覽量:0

2022年《MOLECULAR CANCER THERAPEUTICS》上發表了文章《Enhanced Antitumor Responses of Tumor Antigen-Specific TCR T Cells Genetically Engineered to Produce IL7 and CCL19》,該文章顯示 IL-7 和 CCL19使TCR-T的各方面能力產生質的飛越,這不禁讓小編產生了好奇,為什么會產生如此神奇的效果?
PART 01、IL-7和CCL19在TCR-T上綻放光芒
IL-7(白介素-7)的主要功能是促進胸腺細胞及外周成熟的T細胞的增殖,增加巨噬細胞的細胞毒活性[1]。CCL19(趨化因子19)是促進免疫細胞遷移的細胞因子。在先前的研究中表明,T 區網狀細胞產生的 IL-7 和 CCL19 對于淋巴器官中 T 細胞區的形成和維持至關重要[2]。這一發現促使人們開始關注是否可以通過基因編輯技術使細胞自主分泌IL-7 和 CCL19來增強免疫療法對腫瘤的殺傷作用。
為了研究這類細胞因子是否可以增強腫瘤特異性TCR T細胞的功能[3],該團隊采用了在H-2LD背景下表達P1A腫瘤抗原的P815肥大細胞瘤小鼠模型,以及來自P1A特異性TCR轉基因小鼠的P1A T細胞。該團隊構建了一個編碼IL7、CCL19和EGFP基因的逆轉錄病毒載體(圖1A),他們還準備了一個單獨編碼綠色熒光蛋白的逆轉錄病毒載體作為對照。轉導這些逆轉錄病毒載體后,活化的P1A T細胞表達IL7、CCL19和EGFP(以下簡稱7x19 P1A T細胞)或單獨表達EGFP的P1A T細胞(以下簡稱Conv P1A T細胞),其中EGFP在這些細胞中的表達水平約為70%至80%(圖1B)。EGFP在7x19 P1A T細胞上的表達強度低于Conv P1A T細胞,可能與7x19載體質粒中IL7/CCL19后EGFP的編碼區大小和位置較長有關。我們證實7x19P1A T細胞能顯著分泌IL7和CCL19,但Conv P1A T細胞不能分泌,酶聯免疫吸附試驗(圖1C),構建成功。
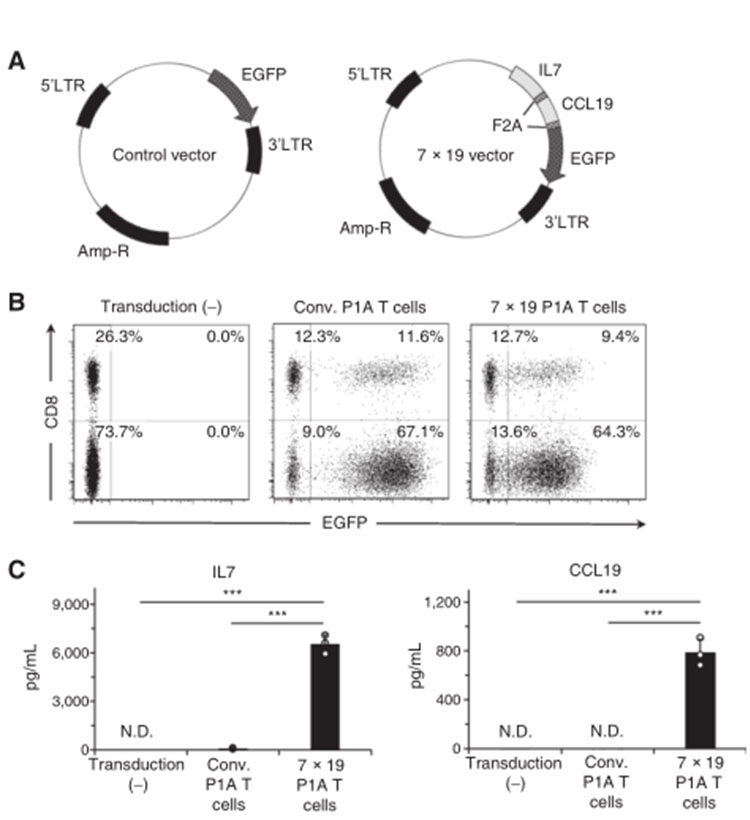
圖1:構建的載體、轉導后的細胞表型和細胞因子的酶聯免疫吸附試驗
為了評價IL7和CCL19的產生對P1A T細胞體內抗腫瘤能力的影響,制作P815腫瘤細胞模型小鼠。設置了預處理組、P1A T細胞組、7x19 P1A T細胞組、不處理組。預處理的小鼠相比預處理加Conv的小鼠和注射P1A T細胞組小鼠沒有顯示出明顯的生存改善(圖2A),也幾乎沒有抑制腫瘤生長(圖2B)。與之形成鮮明對比的是,7x19 P1A T細胞注射預處理組小鼠的生存期顯著延長(圖2A),腫瘤生長受到顯著抑制,甚至有50%的小鼠腫瘤完全消退(圖2B)。這些發現清楚地表明,對腫瘤Ag特異的P1A T細胞進行基因修飾,使其同時產生IL7和CCL19,也能顯著增強抗腫瘤治療活性。P1A T細胞幾乎無抗腫瘤作用。
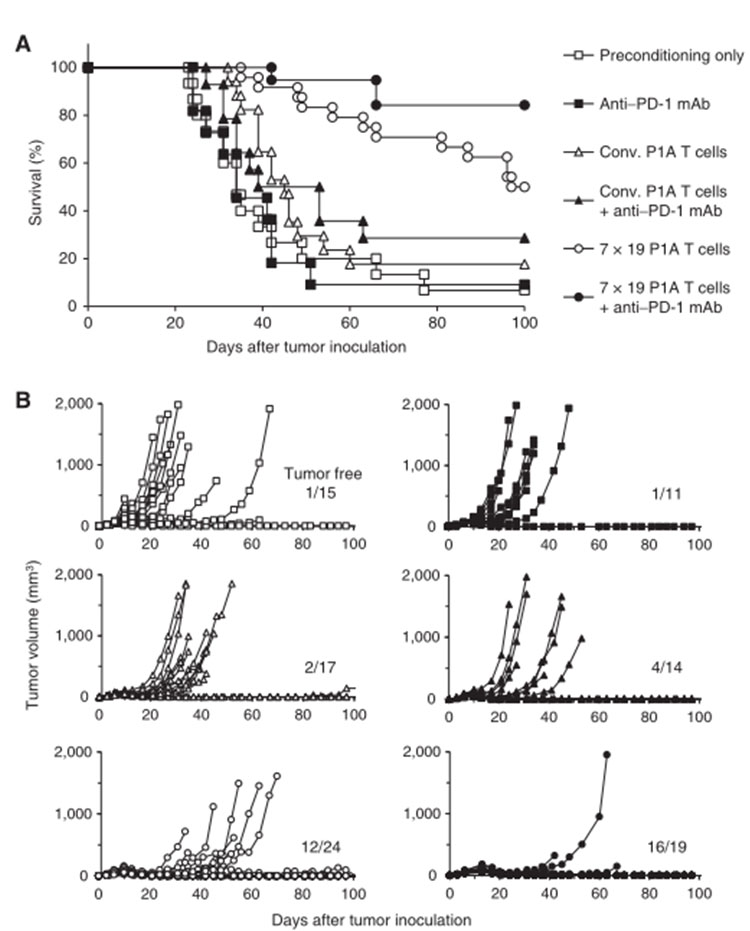
圖2:IL7和CCL19的產生對P1A T細胞體內抗腫瘤能力的影響
PART 02、IL-7和CCL19在CAR-T上大放異彩
那么,這是不是IL7/CCL19第一次在基因編輯的腫瘤免疫治療中發揮作用呢?早在2018年,Adachi K等就研究過IL7/CCL19對CAR-T抗腫瘤活性的影響[4]。
在研究中該團隊成功的產生了一個編碼CAR、IL-7和CCL19的串聯結構。該CAR結構使用hCD20靶點,將該CAR結構導入到小鼠T細胞制成CAR-T。在培養的時候發現CAR在7x19 的CAR-T細胞中的表達與常規CAR-T細胞相差無幾。并且發現7x19 CAR-T細胞與抗CD3抗體或表達hCD20的P815肥大細胞瘤(P815-hCD20)共培養時產生了IL-7和CCL19,成功使CAR-T細胞在自身沒有受到影響的情況下分泌出IL-7和CCL19。
由于已知 IL-7 可增強 T 細胞的增殖和存活隨后該團隊針對IL-7和CCL19的作用實施了一系列實驗,發現與傳統的 CAR-T 細胞相比,7x19 CAR-T 細胞的增殖數量要高得多。在與P815-hCD20長期的共培養過程中,7 × 19 CAR-T細胞持續擴增,而對常規 CAR-T細胞幾乎沒有影響(圖3a,b)。因為 CCL19 是 T 細胞和 DCs的趨化劑,該團隊接下來進行了transwell 遷移測定。與傳統的 CAR-T 細胞相比,7 × 19 CAR-T 細胞孵育顯著增強了應答 T 細胞的遷移(圖3c)。常規和 7 × 19 CAR-T 細胞對 P815-hCD20 細胞表現出相當的殺傷效果,而兩者均未表現出對 hCD20 陰性 P815 細胞的溶解(圖3d)。
為證實該CAR-T的優異的性能表現是因為IL-7和CCL19的影響,該團隊使用了抗CD127抗體來抑制細胞上IL-7的受體,從而降低IL-7的作用。使用抗CCR-19的抗體來抑制CCL19的受體降低CCL19的作用。7 × 19 CAR-T細胞的強增殖能力被抗CD127抗體削弱了,但使用抗CCR7抗體則無影響,表明IL-7對于7 × 19 CAR-T細胞中細胞增殖和存活的改善是必需的(圖3e)。另一方面,包含抗CCR7抗體,而不是抗CD127抗體,完全消除了應答細胞的遷移(圖3f),使用抗CD127的抗體的CAR-T則無影響,表明7 × 19 CAR-T細胞通過CC 19-CCR 7相互作用介導其趨化活性。

圖 3:(7 × 19)CAR-T的增殖、遷移先關實驗結果
接下來,該團隊使用P815-hCD20腫瘤在小鼠模型中研究了7 × 19 CAR-T細胞的體內抗腫瘤作用。首先,該團隊通過靜脈注射1 × 106個常規或7 × 19 CAR-T細胞來治療小鼠。用7 × 19 CAR-T細胞治療比傳統方法延長了存活時間,但所有小鼠最終都死亡了,這促使該團隊采用環磷酰胺(CPA)預處理淋巴細胞缺失。單獨的CPA預處理導致小鼠存活的輕微延長(圖4a,b ),在CPA的基礎上使用常規CAR-T細胞預處理,比單獨的CPA處理略有改善。相比之下,在CPA的基礎上使用7 × 19 CAR-T細胞治療誘導腫瘤完全消退,小鼠長期存活而無腫瘤復發。隨著常規CAR-T細胞的劑量增加顯示小鼠存活率提高,表明常規CAR-T細胞在體內具有可測量的但較弱的腫瘤殺傷效果。總之,該團隊研究結果表明,1 × 106個7 × 19 CAR-T細胞誘導的抗腫瘤作用大于或至少相當于4 × 106個常規CAR-T細胞誘導的抗腫瘤作用,表明7 × 19 CAR-T細胞對實體瘤的治療潛力增強。

圖4:P815-hCD20腫瘤在小鼠模型中研究了7 × 19 CAR-T細胞的體內抗腫瘤作用
通過以上實驗不難看出IL-7和CCL19在免疫細胞治療方面的積極作用,通過基因技術對免疫細胞進行改造使其功效大幅度的提升可以說為腫瘤患者燃起新的希望。希望在不久的將來,在千萬科研工作者的努力下,IL-7和CCL19在免疫細胞治療方面的功效可以真正的落實到患者身上,給予癌癥患者新的曙光。
參考文獻:
[1] Link, A. et al. Fibroblastic reticular cells in lymph nodes regulate the homeostasis
of naive T cells. Nat. Immunol. 8, 1255–1265 (2007).
[2] Luther, S.A. et al. Differing activities of homeostatic chemokines CCL19, CCL21,
and CXCL12 in lymphocyte and dendritic cell recruitment and lymphoid neogenesis.
J. Immunol. 169, 424–433 (2002).K
[3] Tokunaga Y, Sasaki T, Goto S, Adachi K, Sakoda Y, Tamada K. Enhanced Antitumor Responses of Tumor Antigen-Specific TCR T Cells Genetically Engineered to Produce IL7 and CCL19. Mol Cancer Ther. 2022 Jan;21(1):138-148.
[4] Adachi K, Kano Y, Nagai T, Okuyama N, Sakoda Y, Tamada K. IL-7 and CCL19 expression in CAR-T cells improves immune cell infiltration and CAR-T cell survival in the tumor. Nat Biotechnol. 2018 Apr;36(4):346-351.