發布時間:2024-08-06 瀏覽量:0

近年來,過繼細胞療法(ACTs),特別是嵌合抗原受體T細胞(CAR-T)療法,已被證明是最有前途的癌癥免疫治療策略之一。迄今為止,全球已獲批上市的CAR-T產品共計11款,CAR-T療法可以顯著改善患者的預后,在血液系統惡性腫瘤的治療中顯示出強有力的療效。
然而,CAR-T療法在治療實體瘤方面仍面臨著重大挑戰。這主要是由于實體瘤的免疫抑制腫瘤微環境( TME)、腫瘤部位的細胞外基質(ECM)難以浸潤、缺乏腫瘤特異性抗原、抗原逃逸等。而靶向實體腫瘤的CAR-巨噬細胞是克服這些障礙的潛在候選者,在許多癌癥中,巨噬細胞占腫瘤浸潤免疫細胞的大多數,且具有更豐富的抗腫瘤機制和更好的腫瘤浸潤持久性。因此,CAR-巨噬細胞在治療實體腫瘤方面具有令人鼓舞的潛在優勢。
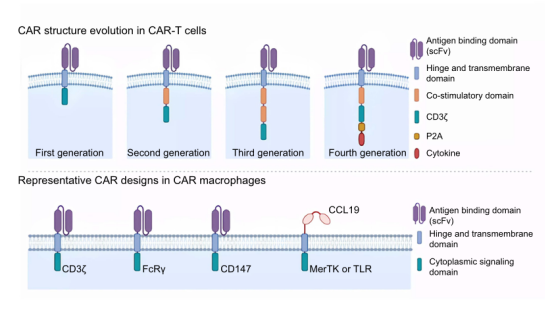
CAR-T細胞和CAR-巨噬細胞的CAR結構
PART 01
CAR-T細胞中的CAR結構
CAR- T細胞中使用的常規CAR包括四個結構域:抗原結合結構域、鉸鏈區、跨膜結構域和一個或多個細胞質信號傳導結構域(圖1)。目前,在CAR-T研究和臨床試驗中,第二代CAR是最普遍的選擇。此外,CAR設計的進步催生了第三代、第四代和其他創新結構,如Split CARs、iCARs和SynNotch CARs。這些設計旨在提高抗腫瘤療效以及減輕嚴重的副作用。
CAR-巨噬細胞中的CAR結構
CAR-巨噬細胞中使用的CAR結構包括抗原結合域、鉸鏈區、跨膜域和細胞質信號域(圖1)。CAR-M常用的胞內信號傳導結構域主要為CD3、CD147、Megf10和FcR。CAR-巨噬細胞特有的信號域可以賦予CAR-巨噬細胞一些獨特的抗腫瘤機制。最具代表性的是來自CD147的激活域,這個信號域不是觸發吞噬,而是上調基質金屬蛋白酶(MMPs)的表達和分泌。MMPs可以降解實體瘤周圍致密的ECM,促進免疫細胞浸潤到腫瘤部位。
CAR-T細胞和CAR-巨噬細胞的對抗腫瘤機制
PART 02
CAR-T細胞的抗腫瘤機制包括:穿孔素顆粒酶途徑、死亡受體途徑和細胞因子分泌。CAR-T細胞識別腫瘤抗原后,通過穿孔素-顆粒酶途徑(細胞凋亡的內在途徑)或死亡受體途徑(細胞凋亡的外在途徑)誘導腫瘤細胞的細胞毒性。凋亡的腫瘤細胞釋放新的腫瘤抗原,這些抗原隨后被抗原呈遞細胞(APCs)吞噬,然后APC將這些新的抗原呈遞給內源性T細胞。CAR-T細胞還與其他免疫細胞和腫瘤基質相互作用,通過分泌細胞因子介導腫瘤殺傷。

圖2 | CAR -巨噬細胞治療的抗腫瘤機制
1) CAR -巨噬細胞通過嵌合抗原受體介導的抗原特異性吞噬作用直接殺傷腫瘤細胞;
2) CAR -巨噬細胞與內源性T細胞表現相互作用。一方面,它們將被吞噬的腫瘤抗原呈遞給T細胞,另一方面,CAR -巨噬細胞可能通過共刺激促進內源性T細胞的活化和持久性;
3) CAR -巨噬細胞以CD147作為信號域時,可分泌基質金屬蛋白酶(MMPs),降解實體瘤周圍致密的細胞外基質,從而促進其他免疫細胞的浸潤, 這種新機制為癌癥免疫治療提供了一種有希望的策略;
4) CAR -巨噬細胞表現出m1樣表型,使它們能夠分泌促炎細胞因子(如IL-1、IL-6和TNF-α)來調控腫瘤微環境。
CAR -巨噬細胞治療實體瘤的主要優勢在于其不同的抗腫瘤機制,包括與其他免疫細胞的廣泛相互作用(通過分泌各種促炎細胞因子或作為APC),有效地重新激活TME的能力,促進T細胞浸潤持續性的能力。
實體瘤臨床面臨的挑戰
PART 03
1) 缺乏合適的腫瘤抗原
CAR-T和CAR -巨噬細胞療法共同面臨的一個重大障礙是缺乏合適的TSA或TAAs。而合適的TSAs或TAAs的鑒定仍是一個亟待解決的難題。特別是靶外腫瘤毒性、抗原逃逸現象和腫瘤內抗原異質性。
2) CAR-T細胞浸潤不足和非持續性
CAR-T靶向實體腫瘤的另一個重要障礙是CAR-T細胞對腫瘤部位的浸潤不足且不持久,致密的ECM經常阻礙CAR-T細胞的浸潤。
CAR-T和CAR -巨噬細胞針對實體瘤的臨床試驗
PART 04
迄今為止,全球已有超過200項注冊臨床試驗研究CAR-T細胞治療實體瘤,其中大多數是旨在評估不同CAR-T產品安全性和有效性的I期試驗。膠質瘤、胰腺癌、肺癌、乳腺癌和前列腺癌是最常用于評估的腫瘤類型。最常見的靶向抗原是人表皮生長因子受體2 (HER2)、間皮素和cludin18.2,其中4-1BB是最常用的共刺激結構域。
與CAR-T相比,CAR -巨噬細胞治療的臨床經驗和可用數據有限,仍處于起步階段。截至目前,僅有4項CAR-M相關研究在Clinicaltrials.gov上注冊 (NCT04660929 , NCT04405778,NCT05007379, NCT06224738)。CAR -巨噬細胞治療實體瘤的第一個I期臨床試驗(NCT04660929 CT-0508),主要用來針對復發/難治性HER2過表達的腫瘤患者,2021年3月20日Carisma團隊宣布已完成CT-0508的1期臨床研究首例受試者給藥,這是首個進入臨床的CAR-M療法,同時也意味著正式開啟了CAR-M的新篇章。
截止目前, CT-0508的研究結果表明:接受CT-0508臨床試驗的14名受試者中,有4名受試者(28.6%)疾病獲得穩定。這4名受試者均為HER2 3+患者。所有HER2 2+患者疾病均進展。試驗中報告的大多數不良事件為1-2級,沒有報告劑量限制性毒性,也沒有嚴重(3-4級)細胞因子釋放綜合征(CRS)或任何級別免疫效應細胞相關神經毒性綜合征(ICANS)的病例。靶向HER2的CAR-M細胞療法CT-0508在患有各種實體瘤的患者中顯示出可耐受的安全性和抗腫瘤活性的跡象。CT-0508試驗的研究結果一定程度上支持了CAR-M療法的安全性、可行性和作用機制,但由于研究的匱乏,CAR-M療法仍迫切的需要更多的臨床數據來證實CAR-M治療的可行性。
未來展望
PART 05
CAR-T和CAR-巨噬細胞療法仍然面臨一定的局限性,例如缺乏有效和安全的TSA或TAAs以及治療相關的不良事件,如靶外腫瘤(OTOT)毒性。通過下一代測序技術對腫瘤和正常RNA進行比較分析,同時采用免疫肽組學方法和基于T細胞的檢測,為鑒定實體腫瘤中新的靶向抗原提供了有希望的途徑。通過這些新興的方法,可以識別被稱為新抗原的腫瘤抗原。對于CAR-巨噬細胞的治療,確定新的靶向抗原是減輕OTOT毒性的基本和有效的方法。針對腫瘤部位微環境的新型免疫治療劑也正在徹底改變癌癥治療。
【注】文章內容旨在科普細胞知識,進行學術交流分享,了解行業前沿發展動態,不構成任何應用建議。


