發布時間:2023-05-09 瀏覽量:0
細胞外囊泡 (Extracellular vesicles,EVs)是多種由細胞積極釋放的納米級膜囊泡,是細胞間通信和循環生物標志物的重要工具,具有生物相容性、通用性、儲存方便、安全性高等優點,可運輸信使和非編碼RNA、蛋白質、脂質、DNA等生物活性物質。
細胞外囊泡包括外泌體、核外顆粒體、外來體以及凋亡小體等。
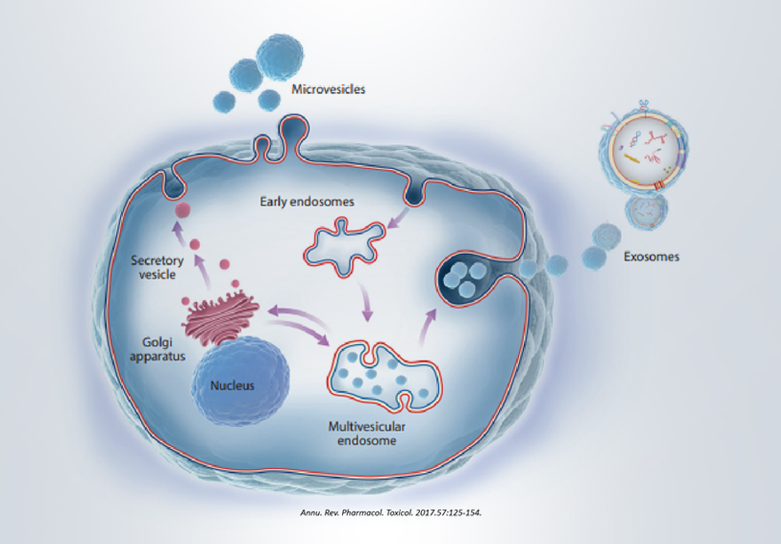
其中外泌體是目前為止定義最為明確的細胞外囊泡。
2013年三位科學家因囊泡運輸調控機制獲得諾貝爾獎后,相關領域的研究迅速成為熱點。
特別是近幾年外泌體相關基金和文章屢創新高,全球科研大咖紛紛扎堆此領域,有關外泌體載藥、診斷、預后監測、免疫療法等方向的文章陸續發表在 Cell、Nature 等各大頂級期刊上。外泌體已成為生命科學/臨床醫學研究的一大熱點。
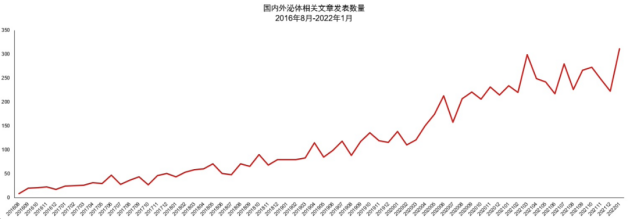
△ 國內外外泌體文章發表數量(圖片來源:產業研報)
研究表明,干細胞來源的外泌體具有與干細胞等同或更優的治療效果,并以更高的操作性、更低的免疫原性以及更利于“貨架銷售”等優勢,成為“無細胞治療”的不二之選,為當前很多難治疾病的治療、“無成藥性”藥物靶點的新型藥物的開發帶來新的機會(圖1)。
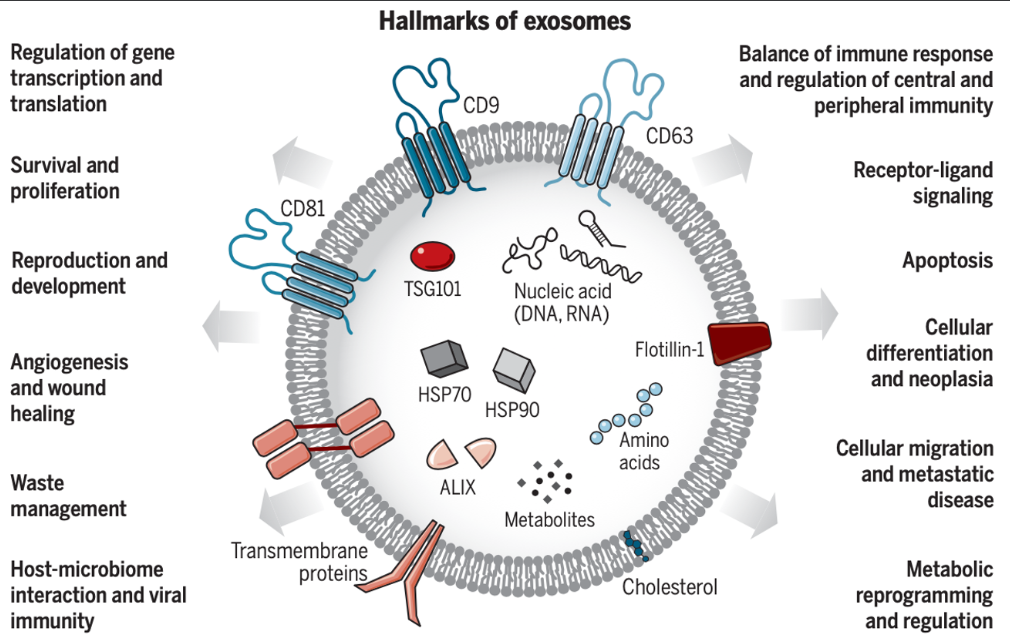
圖一 外泌體的生物學功能和生物醫學應用
盡管外泌體對多種疾病具有治療價值,但它們的應用仍然受到一些缺點的阻礙,包括靶向效率低、治療效果不均勻和產量低。因此,需要先進的工程技術來使外泌體功能化,從而提高它們作為疾病治療藥物的效果。
這些技術主要包括親本細胞預處理以增強固有治療效果、向外泌體裝載治療性藥物、外泌體表面修飾以增強靶向性等。
1、親本細胞預處理技術
預處理包括使用特定培養條件的親本細胞進行操作,如低氧、3D培養和血清剝奪。也可以將生化刺激,包括脂多糖、一氧化氮、促炎細胞因子和外源基因,如質粒DNA和miRNAs,引入培養環境中[1-3]。細胞代謝過程產生的外泌體部分決定了細胞的遺傳和表型特征,這些特征可以通過外源刺激改變[4]。然而,考慮到間充質干細胞的各種生理條件,預處理方法的優化還需要進一步研究。
2、外泌體載藥技術
作為藥物遞送系統的一部分,外泌體可通過釋放自然形成的內容物和裝載的治療劑(例如化學物質、蛋白質、肽和核酸)來處理受體細胞。
藥物裝載策略可分為兩類:內源性(使用各種方法在親代細胞預處理后收集載有藥物的外泌體)和外源性(將外源性藥物裝載到分離的外泌體中)[5]。
內源性可以細分為兩種方法:
第一種,藥物與親代細胞共培養,并且天然存在于分泌的外泌體中。然而,獲得的轉染效率較低,因此該方法主要用于細胞毒性低的化學藥物[6]。
第二種,用脂質體轉染等化學方法轉染親代細胞以攜帶藥物,這種方法主要用于基因藥物,基因藥物可以轉染到親代細胞中以過量表達其感興趣的元件,這些元件隨后被轉移到外泌體中并在靶細胞中發揮作用[7]。
外源性方法主要包括:
1)藥物與提取的外泌體的共培養(對于化學藥物),此裝載藥物的范圍通常僅限于疏水性化合物[8]。
2)使用物理方法將藥物轉移到外泌體中。一種常見物理方法是電穿孔,可以使用弱電流脈沖將電荷加載到外泌體中,通過破壞磷脂雙分子層而形成可恢復的孔來促進藥物加載[9]。其他物理策略,如低滲透析、皂苷孵育、擠壓、超聲處理、pH中和和凍融循環,也已用于將外源性治療藥物裝載到外泌體中[10]。
3)通過化學(例如脂質體)轉染方法將藥物直接轉移到外泌體中。在這種情況下,使用轉染試劑或滲透劑來促進藥物進入外泌體而不破壞脂質雙層結構。例如,已經證明聲學流體是一種將藥物載入溶劑的快速而有效的方法。

3、外泌體表面修飾技術
表面修飾賦予了外泌體獨特的功能,例如通過遺傳操作靶向肽或位點進行化學修飾[11]。
與藥物裝載類似,表面功能化可分為內源功能化和外源功能化。
1)內源性方法可以通過編碼這些分子的載體轉染細胞來對外泌體表面進行基因工程改造,以攜帶特定的肽或配體[12]。此外,外泌體可以使用生物正交化學進行內源修飾,其特征在于高效率和可再現性。
2)與內源性方法相反,外源性表面修飾是通過物理和化學方法直接在外泌體膜上進行。物理方法包括擠壓、超聲波處理和凍融循環[13]。化學方法包括將外泌體脂質或蛋白質構建體與不同的連接基團共價結合,以實現各種功能,例如硫醇-馬來酰亞胺[14]和疊氮炔環加成[15](圖2)。
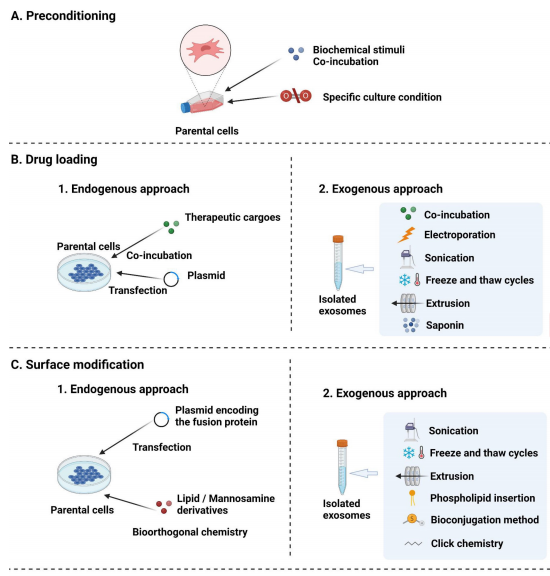
△圖2 外泌體工程化策略
由于外泌體可以穿透血腦屏障的天然優勢及其治療潛力,且具有高生物相容性、低免疫原性、高藥物遞送效率、易于修飾和易于工業化等優點,其作為治療多種疾病的新一代藥物遞送系統已經引起了關注。但是靶向效率低、治療效果不均勻和產量低這些挑戰依然存在。因此,需要先進的工程技術來使外泌體功能化,從而提高其作為治療劑的效率和效力。
由此可見,工程化的外泌體可以成為疾病臨床應用領域的一把“利刃”!
—
參考文獻

