發(fā)布時間:2024-10-30 瀏覽量:0

外泌體(exosome,EXOs)是一種可由多種細胞分泌、直徑為30- 150nm內(nèi)吞起源的膜結合囊泡。而工程化外泌體是指通過遺傳或化學方法改變外泌體的囊泡含量、囊泡膜組分和運輸介質,使其具有特定的生物學功能以增強其穩(wěn)定性、目標靶向性。常見的改性策略主要分為基因工程和化學修飾。基因工程主要是指將外源性的基因導入到母體細胞中,基因在母體細胞中復制、轉錄和翻譯,從而使母體細胞可以特異性的高表達靶向蛋白或多肽,分泌靶向特異性外泌體。化學修飾是指通過化學鍵將功能配體偶聯(lián)到外泌體表面或通過脂質組裝將兩性分子插入到外泌體的脂質雙分子層中,從而將天然或合成的配體裝載到外泌體上[1, 2](圖一)。
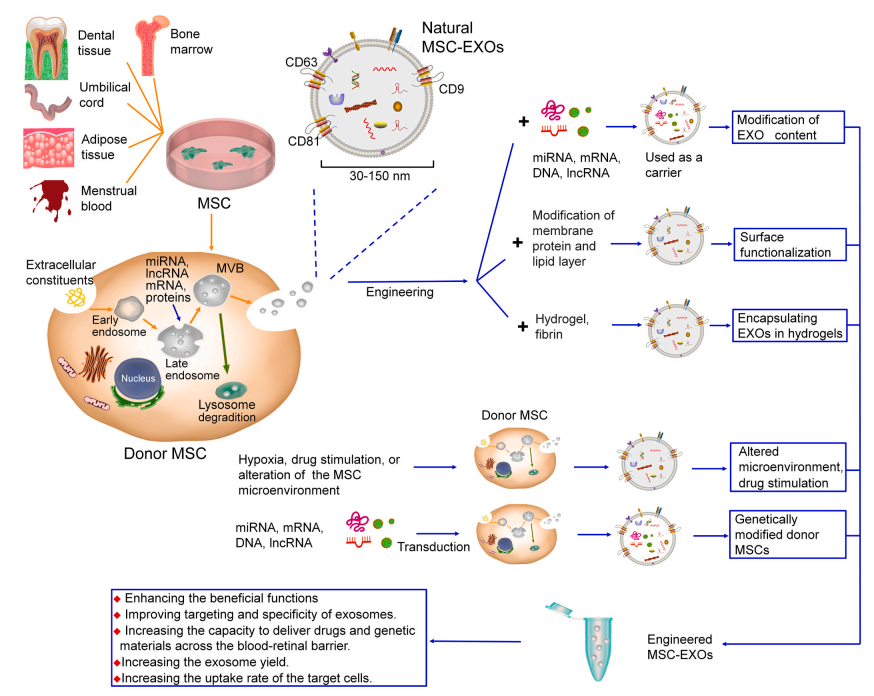
圖一:MSC-EXOs的生物發(fā)生、釋放和工程策略的示意圖
間充質干細胞衍生的外泌體(Mesenchymal stem cell-derived exosomes,MSC-EXOs)與工程技術相結合,在骨關節(jié)炎[3]、中樞神經(jīng)系統(tǒng)[4]等多種疾病治療方面取得了令人滿意的效果。了解MSC- EXOs工程化的研究進展,可能會為眼部疾病的治療提供新的前瞻性治療技術。
干眼癥
dry eye disease,DED
PART 01
DED又名角結膜干燥征,通常以淚膜穩(wěn)態(tài)喪失并伴隨著眼表癥狀為特征,是一種非常常見的眼部疾病。目前全球DED發(fā)病率約為5.5%-33.7%,我國的發(fā)病率約為21%-30%,且患病率隨著年齡的增長而顯著增加[5]。
近年來,隨著人們生活方式和工作方式的改變:電子產(chǎn)品的頻繁使用、長時間的伏案工作、近距離作業(yè)等導致患干眼癥的人群逐年增加。如何避免DED保護眼健康成為了一個亟待解決的公共衛(wèi)生問題。相關研究顯示,Ma等[6]利用化學手段將抗壞血酸(AA)還原的金納米顆粒(AuNPs)沉積在MSCs-EXOs磷脂膜上,對EXOs進行工程化改造。改造后的EXOs相較于任何單一成分,更有效地促進了角膜細胞生長,降低角膜活性氧水平,恢復淚液分泌和抗炎能力,顯著改善DED癥狀(圖二)。
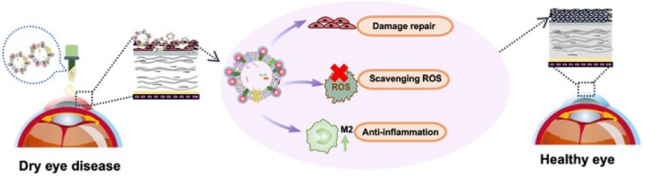
圖二:工程化MSC- EXOs通過修復眼表損傷,清除活性氧,減少炎癥來緩解DED
自身免疫性葡萄膜炎
Autoimmune uveitis,EAU
PART 02
EAU是一種主要由免疫失調(diào)引起的危及視力的眼內(nèi)炎癥。研究顯示,單獨的MSCs- EXOs對免疫抑制的能力較弱,對EXOs進行工程化改造后,可以提高免疫抑制的能力,改善受損或者患病的組織器官。
研究人員利用基因工程技術在MSCs中過表達IL-10,結果發(fā)現(xiàn),過表達IL-10的MSCs- EXOs(sEV-IL10)可以通過抑制T細胞增殖和Th1、Th17細胞分化,促進Treg細胞分化,增加在靶器官中的富集,顯著增強MSCs- EXOs對EAU的治療效果[7]。此研究提示,工程化外泌體技術在治療EAU或者其他自身免疫性疾病方面具有巨大的潛力。
視網(wǎng)膜色素變性
Retinitis pigmentosa,RP
PART 03
RP是一組進行性、遺傳性和營養(yǎng)不良的退行性疾病,由于視網(wǎng)膜色素上皮細胞功能的逐漸喪失和光感受器的進行性凋亡而導致的不可逆的視覺損傷。其中,細胞凋亡在誘導光感受器死亡進而促進上皮細胞功能喪失中發(fā)揮了重要作用。
因此,研究者可以利用基因工程技術手段將具有抗凋亡功效的miRNAs在MSCs中過表達,工程MSCs釋放的EXOs將攜帶上調(diào)的miRNAs,進而收獲具有抗凋亡功效的工程化EXOs,用于RP的治療[8]。如有必要,可以在MSCs中過表達不同功效的miRNAs,如抗炎、抗氧化、抗血管生成、免疫調(diào)節(jié)等,最終得到改造后的EXOs,用于眼部疾病的治療(圖三)。
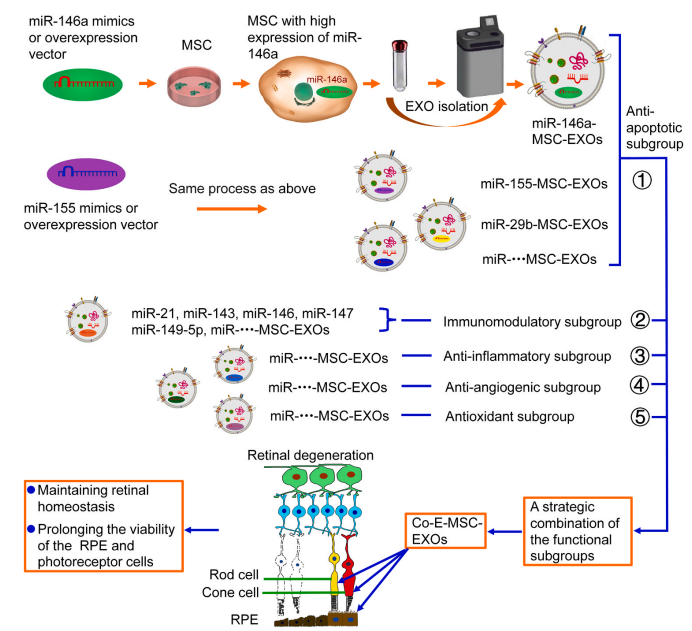
圖三:工程化MSCs- EXOs治療視網(wǎng)膜色素變性的概念示意圖。
年齡相關性黃斑變性
Age-Related Macular Degeneration,AMD
PART 04
濕性AMD是一種視網(wǎng)膜下脈絡膜層新生血管生長的情況。目前治療濕性AMD首選方案是在玻璃體內(nèi)注射抗血管內(nèi)皮生長因子(vascular endothelial growth factor,VEGF)試劑。雖然VEGF可以顯著改善患者的癥狀,但是患者之間的個體差異會造成治療無效性和耐藥性。因此,為了達到最佳治療效果和持續(xù)時間,同時最大限度地減少潛在不良反應,可以將抗-VEGF試劑與抗炎、抗凋亡和抗氧化工程化MSCs-EXOs進行復合,發(fā)揮出協(xié)同增強的功效[8](圖四)。
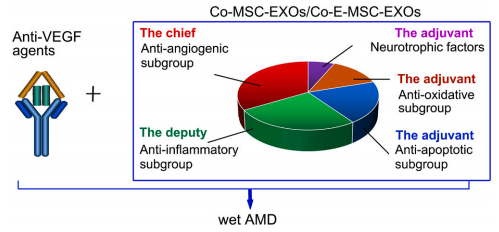
圖四:工程化MSCs- EXOs協(xié)同治療濕性AMD的策略示意圖。
未來展望
PART 05
目前,對MSCs的研究已經(jīng)逐漸從MSCs轉變到MSC- EXOs,提示MSCs- EXOs有潛力作為一種無細胞治療技術取代MSCs,成為應對多種疾病的新方法。EXOs在治療眼部疾病方面具有穩(wěn)定性高、毒性和免疫原性小、遞送效率高、納米載體滲透強等優(yōu)點。但是,其產(chǎn)量有限、長期效果不明確和異質性高等缺點限制了MSCs- EXOs在眼部疾病中的應用。同樣,工程化MSCs- EXOs也面臨著大量生產(chǎn)、存儲方式、工程過程質量控制、工程產(chǎn)品穩(wěn)定性控制等諸多挑戰(zhàn)。工程化MSCs- EXOs作為眼部疾病治療策略的研究才剛剛開始。

隨著對MSCs- EXOs成分及其潛在機制進行更深入的研究,外泌體工程技術的不斷進步,封裝MSCs- EXOs的新型納米顆粒、水凝膠或合成生物材料尖端技術的不斷發(fā)展,相信工程化MSCs- EXOs的靶向性和治療效果將得到實質性的增強。
無論如何,有希望的是,工程化的MSCs- EXOs可能代表下一代靶向遞送載體,能夠將具有生物學意義和臨床治療效果的獨特治療藥物裝載到MSCs- EXOs中,使其能夠特異性靶向病變組織,為眼部疾病的精確、個性化治療提供一種新的、更有效的工具。
【注】文章內(nèi)容旨在科普細胞知識,進行學術交流分享,了解行業(yè)前沿發(fā)展動態(tài),不構成任何應用建議。

